Basic HTML Version


分子植物育种
(
网络版
), 2012
年
,
第
10
卷
,
第
1214
-
1217
页
Fenzi Zhiwu Yuzhong (Online), 2012, Vol.10, 1214
-
1217
http://mpb.5th.sophiapublisher.com
1215
行分析是判断
RNA
质量的一种重要方法,通过对
18S
和
28S
条带的完整性可判断
RNA
有无降解及
降解程度
(
王英等
, 2009)
。从
RNA
琼脂糖凝胶电泳
图可见,利用天根的
RNAplant plus Reagent
试剂盒
未能提取盐胁迫处理后的
107
杨叶片组织总
RNA
(
图
1A)
,提取根组织的
RNA
也已大部分降解
(
图
1B)
;采用天泽柱式植物
RNAout
在叶和根组织中都
提取获得了总
RNA
,但
RNA
浓度较低,需提取大
量组织材料方可用于后续实验;改良的
SDS
方法提
取效率和质量最佳,
28S
与
18S
条带亮度约为
1.5:1
。
这
3
种提取
RNA
方法都存在
DNA
污染,因此,后
续实验中需
DNA
酶进行处理解决。
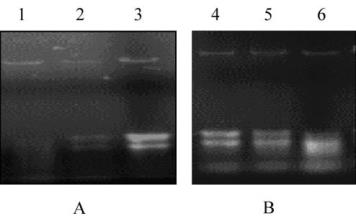
图
1
不同方法提取
107
杨叶片和根总
RNA
电泳图谱
注
: 1, 6: RNAplant plus Reagent
提取叶和根总
RNA; 2, 5:
柱
式植物
RNAout; 3, 4:
改良
SDS
法分别提取叶和根总
RNA
Figure 1 Agarose electrophoresis of total RNA extracted from
leaf and root of poplar 107 by using different methods
Note: 1, 6: Total RNA extracted from leaf and root of poplar
107 by using modified RNAplant plus Reagent method; 2, 5:
Total RNA extracted from the same above by using column
RNAout method; 3, 4: Total RNA extracted from the same
above by using modified SDS method
1.2 RNA
纯度和浓度
RNA
溶液在
230 nm
、
260 nm
、
280 nm
的光密
度分别代表杂质
(
多肽
,
酚
,
糖等
)
和蛋白等有机物
的吸收植。纯
RNA
的
OD
260
/OD
280
值在
1.8~2.1
之
间,小于
1.8
表明蛋白或其他有机物污染,大于
2.1
表明
RNA
已经降解;
OD
260
/OD
230
值<
2.0
,表明溶
液中有残存的盐和小分子杂质,如核苷酸、氨基酸、
酚等。利用
NanoDrop ND
-
1000
微量紫外可见分光
光 度 计 测 量
RNA
样 品 的
OD
260
/OD
280
和
OD
260
/OD
230
比值
(
表
1)
,采用改良
SDS
法和柱式植
物
RNAout
试剂盒得到的
OD
260
/OD
280
和比值为
1.8~2.1
,符合标准的比值,纯度较高。
1.3 RNA
样品的
cDNA
合成及质量检测
利用
3
种方法提取的
RNA
作为模板进行反转
录,将合成的
cDNA
进行
PCR
扩增,以检测
RNA
的质量。
RT-PCR
电泳结果如图
2
所示,改良
SDS
法所提取的
RNA
经反转录后,可扩增出目的条带;
柱式
RNAout
法提取根
RNA
可扩增出目的条带,
但条带微弱;
RNAplant plus Reagent
法所提取的
RNA
未能扩增出条带,与其所提的
RNA
质量有关。
图
2
杨树
UBQ
基因的
RT-PCR
产物
注
: 1~3:
分别为改良
SDS
法
,
天根
RNAplant plus Reagent
试
剂盒和天泽柱式植物
RNAout
提取叶片总
RNA
的反转录产物
;
4~6:
分别为改良
SDS
法
,
天根
RNAplant plus Reagent
试剂盒
和天泽柱式植物
RNAout
提取根总
RNA
的反转录产物
Figure 2 RT-PCR products of poplar
UBQ
gene
Note: 1~3: RT-PCR products of total RNA from leaf isolated
with modified SDS method, RNAplant plus Reagent and
column RNAout; 4~6: RT-PCR products of total RNA from
root isolated with modified SDS method, RNAplant plus
Reagent and column RNAout
2
讨论
目前,对于木本植物不同种、不同部位
RNA
的提取,研究人员已总结出不同的方法,但在实际
操作过程中,用同一套提取方法不能保证获得同样
的效果。如柱式
RNAout
法提取叶片和根中
RNA
,
将所获得的
RNA
反转录后进行
PCR
,在叶中不能
扩增出目的条带,而在根中扩增出了微弱条带。
杨树受盐胁迫后,会产生大量的次生代谢物,
当细胞裂解后就会释放出来,并与多酚氧化酶反应
成褐色,其氧化生成多元琨类物质与
RNA
发生不
可逆结合,导致
RNA
降解、丢失、难溶解
(
郭丽霞
等
, 2007;
肖洁凝等
, 2003)
。在提取液中加入高浓度
的
β
-巯基乙醇可以防止酚类物质被氧化及其与
RNA
结合。本试验在提取缓冲液中加入
5%
的
β
-
巯基乙醇防止酚类物质氧化。
植物在短时间内受盐胁迫后,会产生大量的多
糖,而多糖的存在则是
RNA
提取一大障碍,因为
多糖的结构与
RNA
相似,去除多糖的过程中,
RNA
也将同时被去除,减少
RNA
产量;另外,含有多
糖的
RNA
沉淀难溶于水,而且多糖可抑制酶活,

