Basic HTML Version


分子植物育种
(
网络版
), 2012
年
,
第
10
卷
,
第
1191
-
1198
页
Fenzi Zhiwu Yuzhong (Online), 2012, Vol.10, 1191
-
1198
http://mpb.5th.sophiapublisher.com
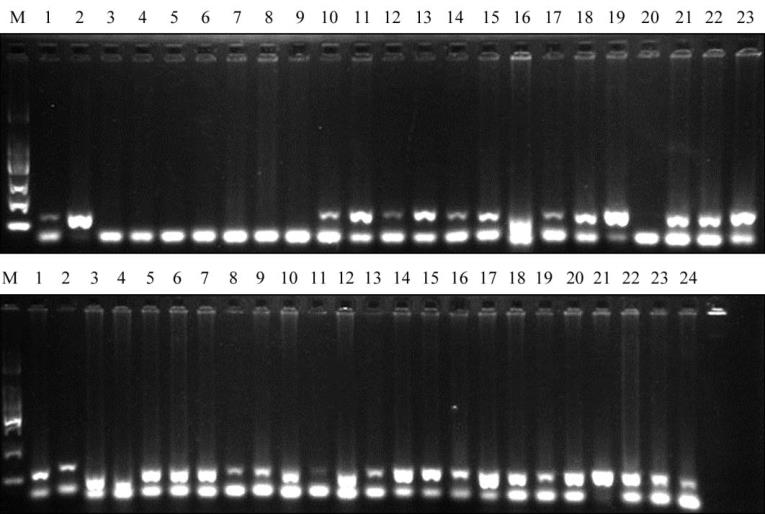
1195
图
7
断穗引物
Xgwm161
在在
47
份小麦材料中的
PCR
扩增
注
:
上排
1~23
和下排
1~24
泳道模板
DNA
为
47
个不同小麦材料的基因组
DNA; M: DL2000 marker
Figure 7 PCR amplification by brittle rachis primer Xgwm161 among 47 wheat accessions
Note: Upper 1~23 and lower 1~24 is 47 wheat accessions DNA; M: DL2000 marker
真正的目的产物;
dNTP
不仅是反应体系中的重要
物质,而且它在浓度过低时会使
PCR
扩增效率降
低,反过来,它又将同
Taq
聚合酶抢夺
Mg
2+
,使
Mg
2+
浓度降低,从而弱化
Taq
酶活性,并使扩增量
显著减少;在反应体系中保证有足够、特异性显著
且浓度适当的引物量也是利用这项工具或手段必
须要考虑的因素之一,过高的引物浓度不但会增加
非特异性扩增物的数量,而且还会使它自己形成二
聚体;而过高的模板
DNA
和
Taq
聚合酶的浓度也
会导致
PCR
反应中非特异性扩增物的增加,相反,
则使目的产物减少
(Sato et al., 2005)
。除此外,这些
成分之间的相互作用,如
dNTP
同
Taq
聚合酶、以
及与模板
DNA
抢夺
Mg
2+
等,也都对最终获得的扩
增物数量和质量有较大影响。因此,在利用
SSR
标
记这项手段开展相关的研究之前,针对要具体研究
的目标首先构建起适合对象的反应体系是利用这
项工具的基本条件。
我们通过对上述这些影响
PCR
扩增效果的成
分的浓度或用量进行反复试验与优化,建立起了一
套适用于云南小麦
SSR
分子标记研究的最佳反应
体系。该体系不仅扩增出了清晰、强弱明显的谱带,
而且可重复性也非常好。这将为从
DNA
分子水平
上研究云南小麦的起源演化、系统分类、品种鉴别
或抗病性基因发掘等提供分子生物学基础。
3
材料和方法
3.1
植物材料与试剂
本实验所用的
37
份云南小麦及对照小麦品种
中国春来源于云南省作物种质中期保存库,陕西节
节麦、中东山羊草、野生一粒小麦、乌拉尔图小麦、
栽培一粒小麦、野生二粒小麦、东方小麦、波兰小
麦和波斯小麦等
9
份材料来源于中国农业科学院作
物科学研究所。这些材料的新鲜、无病斑幼嫩叶全
部采自本所试验地。本实验所用的
SSR
引物由上海
捷瑞生物工程有限公司合成,
10 X buffer (
含镁离子
浓度
18 mmol/L)
,
dNTP
和
TaqDNA
聚合酶则购自
TaKaRa
。
3.2 DNA
的提取方法
我们采用改良的
CTAB
提取法
(
夏铭等
, 1999;
柴建芳等
, 2006)
提取了所有参试材料的全基因组
DNA
。具体的提取过程为:称取
1 g
左右的参试材
料的新鲜叶片,用液氮将其研磨成粉末状,装入
1.5 mL
的
Eppendorf
管中,再加入
CTAB
提取液
(
含
2%
的
CTAB, 100 mmol/L
的
TrisHCl (Ph 8.0), 20 mmol/L

