Basic HTML Version


分子植物育种
(
网络版
), 2012
年
,
第
10
卷
,
第
1191
-
1198
页
Fenzi Zhiwu Yuzhong (Online), 2012, Vol.10, 1191
-
1198
http://mpb.5th.sophiapublisher.com
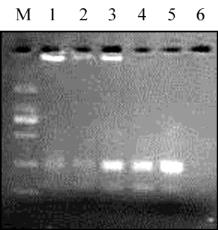
1193
增出的产物很少,而在
0.2 mmol/L~0.3 mmol/L
时
出现的产物最多,并以
0.25 mmol/L
时的条带多而
清晰,在
0.35 mmol/L
时则又无扩增产物。因此,
我们认为
0.25 mmol/L
的
dNTP
浓度应是云南铁壳
麦
SSR
反应的最适浓度。
图
2 dNTP
浓度试验结果
注
: M: DL2000 marker, 1~6
泳道的
dNTP
浓度分别为
:
0.1 mmol/L, 0.15 mmol/L, 0.2 mmol/L, 0.25 mmol/L, 0.3 mmol/L
和
0.35 mmol/L
Figure 2 Result of dNTP concentration
Note: M: DL2000 marker, 1~6 dNTP concentration: 0.1 mmol/L,
0.15 mmol/L, 0.2 mmol/L, 0.25 mmol/L, 0.3 mmol/L and
0.35 mmol/L
1.3
引物浓度的筛选
我们设计了
0.06 μmol/L
、
0.1 μmol/L
、
0.14 μmol/L
和
0.18 μmol/L
四种不同的引物浓度来检验
PCR
的扩增效果
(
扩增结果如图
3)
。从扩增出的条带
多少和清晰度看,引物浓度在
0.06 μmol/L
以下
时产生的扩增物太少,甚至根本没有扩增物,在
0.1 μmol/L~0.18 μmol/L
之间时不但有较多的扩增
物,而且以
0.1 μmol/L
时的条带效果最好。因此,
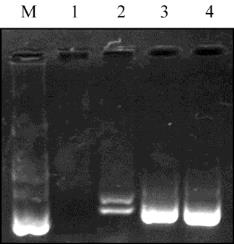
图
3
引物浓度试验结果
注
: M: DL2000 marker, 1~4
泳道的引物浓度分别为
: 0.06 μmol/L,
0.1 μmol/L, 0.14 μmol/L
和
0.18 μmol/L
Figure 3 Result of Primer concentration
Note: M: DL2000 marker, 1~4 Primer concentration: 0.06 μmol/L,
0.1 μmol/L, 0.14 μmol/L and 0.18 μmol/L
我们选用
0.1 μmol/L
的引物浓度作为云南铁壳麦
SSR
反应的最适浓度。
1.4
模板
DNA
浓度的筛选
实验中对
10 ng
、
20 ng
、
30 ng
和
40 ng
四种不
同的模板
DNA
浓度进行了
PCR
扩增检验
(
扩增结果
如图
4)
。模板
DNA
浓度太低,则分子碰撞的几率
也越低,偶然性增大,扩增物也就不稳定;模板浓
度过高则会造成条带模糊,出现弥散现象。从图
4
看,
30 ng
时扩增出的条带较其他浓度的都清晰。
因此,我们选用
30 ng
的模板
DNA
作为最适浓度。
图
4 DNA
浓度试验结果
注
: M: Ecol-λ T14 marker, 1~5
泳道的引物浓度分别为
: 30 ng,
40 ng, 40 ng, 20 ng
和
10 ng
Figure 4 Result of Taq polymerase concentration
Note: M: Ecol-λ T14 marker, 1~5 DNA concentration: 30 ng,
40 ng, 40 ng, 20 ng and 10 ng
1.5
Taq
DNA
聚合酶浓度的筛选
在
PCR
反应中,
Taq
酶的用量也是影响实验结
果的一个重要因素。使用高浓度的
Taq
酶不但造成
浪费,而且很容易发生高错配率、产生非特异性扩
增物;过低则会导致产物的合成效率下降。在随机
扩增反应中,一般应将
Taq
酶的浓度控制在
0.5 U~5
U
之间
(
余艳等
, 2003)
。
我们通过对
0.5 U
、
1.0 U
、
1.5 U
和
2.0 U
四种
不同的
Taq
DNA
聚合酶浓度的
PCR
扩增
(
扩增结果
如图
5)
表明,
Taq
酶浓度在
1.5 U
时扩增出的产物
多且较清晰,而低于
1.5 U
时扩增出的产物减少,
但高于
1.5 U
时又无扩增物出现。因此,为了既不
影响扩增物又避免过多的浪费,我们选用
1.5 U
的
Taq
DNA
聚合酶作为云南铁壳麦
SSR
反应的最
适浓度。
1.6
建立优化的
SSR
反应体系
我们通过不同浓度的
Mg
2+
、
dNTP
、引物、模

