Basic HTML Version


分子植物育种
(
网络版
), 2012
年
,
第
10
卷
,
第
1012-1016
页
Fenzi Zhiwu Yuzhong (Online), 2012, Vol.10, 1012-1016
http://mpb.5th.sophiapublisher.com
1014
表
2
低温预处理
(4
℃
)
对原生质体产量的影响
Table 2 Influence of pre-treatment in 4
℃
on yield of protoplast
预处理时间
(h)
Pre-treating time (h)
原生质体产量
(×10
6
cells/gFW)
Yield of protoplast (×10
6
cells/gFW)
0
6.42+0.20 b
12
7.04+0.06 a
18
4.65+0.082c
24
2.56+0.06 d
注
:
数据后不同字母表示在
5%
水平上差异显著
Note: Different letters in the same column indicate significant
difference at 5% level
1.3
纯化离心对原生质体产量的影响
细胞质雄性不育系
21A
的无菌苗叶片经酶解过
滤后,测得原生质体产量为
6.42×10
6
cells/g FW
,原
生质体纯化时不同离心转速及离心时间对原生质体
产量的影响表明
(
表
3)
,当离心转速较低时
(500 r/min)
,
在
6~10 min
之间,原生质体产量随时间延长而增
加,原生质体不易聚集在离心管底部;提高离心转
速至
800 r/min
,在
6~10 min
之间,原生质体产量
随时间延长而减少,但原生质体易在离心管底部聚
集,其中以离心
8 min
的效果最佳;而当离心转速
提高至
1 000 r/min
时,原生质体产量随时间延长明
显下降,主要表现为原生质体破裂。
1.4
愈伤组织形成
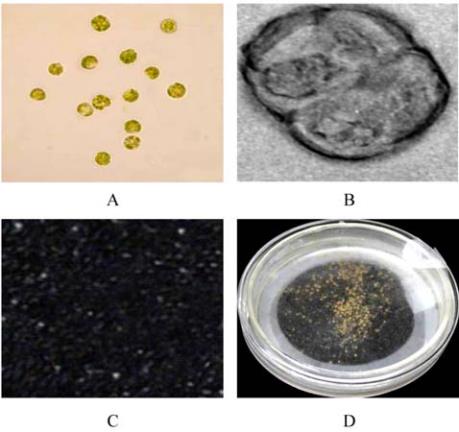
辣椒无菌苗在
4
℃下预处理
12 h
,叶片经
1%
纤
维素酶
+0.5%
离析酶
+0.2%
果胶酶酶解、过滤和纯化
后可产生大量有活力原生质体
(
图
1A)
,培养约
48 h
,
发生第一次分裂
(
图
1B)
。前
3
周进行暗培养,每隔
1
周添加
1 mL
稀释培养基,
3
周后将培养物于漫射
光下进行培养,当出现肉眼可见的愈伤组织时
(
图
1C)
,将其转移至扩增培养基弱射光下培养,随后
可获得。
图
1
辣椒原生质体分离培养及愈伤组织形成
注
: A:
纯化的原生质体
; B:
第一次细胞分裂
; C:
微愈伤组
织
; D:
愈伤组织
Figure 1 Isolation and culture of protoplasts true leaves of
pepper (
Capsicum annuum
L) and callus formation.
Note: A: Purified protoplast; B: First cell division; C: Micro
callus; D: Callus
表
3
离心转速及离心时间对原生质体产量的影响
Table 3 Effects of and time of centrifugation on the yield of protoplasts
离心转速
(r/min)
Speed of centrifugation (r/min)
离心时间
(min)
Time of centrifugation (min)
原生质体产量
(×10
6
cells/gFW)
Yield protoplast (×10
6
cells/gFW)
500
6
3.58+0.10 f
500
8
4.32+0.14 e
500
10
4.67+0.18 d
800
6
6.13+0.22 ab
800
8
6.28+0.18 a
800
10
5.94+0.10 b
1000
6
4.91+0.33 c
1000
8
3.74+0.17 f
注
:
数据后不同字母表示在
5%
水平上差异显著
Note: Different letters in the same column indicate significant difference at 5% level

