Basic HTML Version
陈罡等
, 2011,
美国白蜡
SRAP-PCR
反应体系的建立与优化
,
分子植物育种
Vol.9 No.74 (doi: 10.5376/mpb.cn.2011.09.0074)
1543
扩增体系是可行的。选用的
8
对引物组合均能在
4
个材料中扩增出多态性条带,且多态性位点丰富,
说明
SRAP
标记适合用于美国白蜡品种的遗传多样
性分析及分子鉴定。
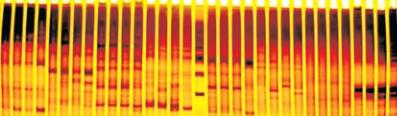
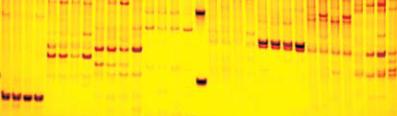
图
9 8
对引物组合在
4
个不同种源美国白蜡材料中扩增出的
SRAP
条带
Figure 9 SRAP fragment amplified by primer combination in
different material
Fraxinus americana
2
讨论
美国白蜡生长速度快,绿化效果好,是沿海湿
地造林的优良树种之一。因其抗逆性强,具有优良
的抗逆基因资源,是进行林木抗性育种研究的理想
材料。由于美国白蜡遗传基础材料匮乏,并且为多
年生木本植物、世代周期长、遗传高度复杂等原因,
利用传统林木遗传育种的方法难以在分子水平上
揭示其遗传基础。
DNA
分子标记技术是直接对其
DNA
进行研究,不受环境和发育阶段的影响,更具
目的性和高效性,是对其进行遗传图谱构建、不同
品种遗传多样性分析、良种鉴定及抗性基因定位等
研究的有力工具。
SRAP
标记是目前一种较为理想的分子标记技
术,与其他常用的分子标记相比,弥补了它们的一
些不足,而且更能反应表型的多样性及进化史
(Ferriol et al., 2003a, 2003b)
,提供的信息也更为优
良
(Ferriol et al., 2004)
。
SRAP
标记引物通用性强,
不需要预知物种的序列信息,因此应用广泛。目前,
已经在蔬菜作物、果树等多种植物的遗传育种研究
中成功应用,在林木指纹图谱建立
(
王宇等
, 2007,
林业实用技术
, (5): 3-5)
、种质鉴定
(
於朝广等
, 2009)
及林木遗传多样性分析
(
陈罡等
, 2010;
王骞春等
,
2010,
辽宁林业科技
, (6): 19-21, 48)
等方面研究也
已陆续开展,本试验首次对美国白蜡的
SRAP-PCR
扩增体系进行优化,建立的扩增体系稳定可靠,能
够很好的用于美国白蜡分子遗传育种研究。
由于
SRAP
标记是一种基于
PCR
的分子标记技
术,扩增结果受反应条件、材料、药品及仪器不同
等因素的影响,因此在应用前应对其扩增体系进行
优化,根据实际所用进行调整。
SRAP
体系优化的
方法有多种,本试验对其反应体系中
5
个因素进行
正交设计,得到了美国白蜡
SRAP-PCR
的最佳扩增
体系,试验快捷简便,结果科学可靠。但该方法也
存在一定局限性,在对扩增谱带的优劣判断上带有
一定的主观成分,不能很好地说明各因素间的互作
等,如果能够建立客观的
PCR
扩增结果评价标准,
则能极大的促进以
PCR
技术为基础的分子标记技
术的应用。
3
材料与方法
3.1
试验材料
供试材料为辽宁省林业科学研究院从美国引
进不同种源的美国白蜡成熟饱满种子,经组培扩繁
获得实生苗后,剪取其幼嫩叶片-
70
℃保存备用。
3.2
基因组
DNA
提取
采用
CTAB
法并略加改进后提取基因组
DNA
。
用
1%
琼脂糖凝胶电泳检测提取
DNA
的质量及完整
性,并用
UV1102
紫外分光光度计测定其浓度,选
出适宜的作为模板
DNA
,稀释至所需浓度后,-
20
℃
保存备用。
3.3
引物筛选
SRAP
引物采用已发表
(Li and Quiros, 2001)
的
引物组合,由北京赛百胜生物公司合成。随机选取
16
对引物组合,参考
Li
和
Quiros
的扩增反应体系
及程序,进行引物筛选,选择条带丰富清晰的引物
组合进行优化实验。
3.4 SRAP-PCR
反应体系及扩增条件
采用正交设计确定
PCR
反应中
5
个因素
(Mg
2+
,
dNTP,
引物
,
Taq
DNA
聚合酶及模板
DNA)
的最佳
水平,正交设计方案
(
表
1)
。随机选取一个模板按表
1
中的
16
个处理进行实验,每处理重复
2
次。扩增
反应均在
PTC-200
型
PCR
仪
(BIO-RAD)
上进行。反
应总体系为
25
μ
L
,扩增程序首先是
94
℃预变性
5
min
;然后前
5
个循环为:
94
℃变性
30 s
,
37
℃退

