Basic HTML Version

王帮太等
, 2011, SSR
标记简便快速鉴定玉米品种纯度
,
分子植物育种
Vol.9 No.60 (doi: 10.5376/mpb.cn.2011.09.0060)
1447
5 µL
的微量扩增体系,加快了分子标记检测的速度,
降低了分子标记检测过程中的消耗。
为了进一步优化
SSR
分子标记检测环节,缩短
检测时间,降低检测中的消耗,研究适合于玉米种
子纯度检测的高效、快速、经济的
SSR
标记检测体
系。本试验在以往研究的基础上,建立了以单籽粒
微量胚乳碱煮法提取
DNA
、
2.5 µL
超微量
PCR
扩增
体系、多排上样电泳检测及两步法银染显影为一体
的
SSR
标记检测玉米种子纯度的新型检测体系,并
利用该体系对河南浚单种业浚单系列品种进行了
种子纯度的检测。
1
结果与分析
1.1
高效、快速、经济的玉米种子
SSR
标记纯度检测
体系
1.1.1 DNA
提取方法的优化
本研究在赵久然
(2009)
的单粒种子胚乳
DNA
快
速提取方法的基础上,作了进一步的优化:将提取
液降至
50 µL
,将
TE
缓冲液降至
100 µL
,这样更有
利于
DNA
样品的混合,节省了药品,且提取
DNA
质量完全可以满足
SSR
标记扩增需求
(
图
1)
。
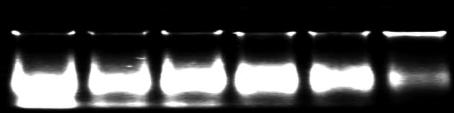
图
1 DNA
琼脂糖凝胶电泳图
注
: 1~4:
碱煮法微量胚乳提取
; CK:
普通方法小量叶片提取
未纯化
Figure 1 Agarose gel electrophoresis results of DNA
Note: 1~4: Alkaline-heating for DNA extraction, CK:
unpurified DNA with leaves extraction
1.1.2
玉米
SSR
扩增体系的优化
在前研究的
5 µL
扩增体系的基础上
(
王帮太
,
2009a)
,采用
Taq
PCR MasterMix
高效扩增剂,进一
步缩小扩增体系,将体积降至
2.5 µL
。结果表明,
三种扩增体系均能清楚地扩增目标带型,相比而
言,
2.5 µL
扩增量稍小,电泳检测时间不宜过长
(
图
2)
。但
2.5 µL
检测体系成本最低,扩增结束后,加
入
2 µL
变性剂进行变性,总体积在
4.5 µL
左右,上
样量约
2.5 µL
进行电泳检测,可以保证第二次重复
检测的需要。
图
2 umc1666
在
7.5 µL (1~5), 5 µL (6~10), 2.5 µL (11~15)
扩增
体系电泳图
注
: CK:
空白对照
Figure 2 PCR amplification results of umc1666 with 7.5 µL, 5 µL,
and 2.5 µL system
Note: CK is for blank contrast
1.1.3
玉米
SSR
电泳检测技术的优化
采用
4.5%
的变性聚丙烯酰胺胶对扩增样品进
行检测
(
王帮太
, 2009b)
,如果选取的引物多态性较
好、特异性高,每块测序胶可以检测
4
排样品。对
银染显影技术进行了优化,省去了传统显影过程中
的固定步骤,采用直接银染后显影的两步显影法,
由于不需要对胶带进行特殊保存,只需照相保存即
可,省去对胶带的终止固定,显影完成后只需用自
来水冲洗残余氢氧化钠即可。
利用本研究建立的
SSR
检测体系,一个熟练的
实验操作员在一个工作日内对两份送检的玉米品
种
(200
粒
)
进行纯度检测,统筹安排工作流程,当日
即可提供检测结果。
1.2
玉米
SSR
检测体系的应用
采用本研究建立的
SSR
玉米纯度检测体系。选
用
10
对
SSR
引物对浚单
22
、浚单
26
、浚单
28
、浚单
29
进行亲本多态性筛选,最终确定了使用引物
bnlg1396
检测浚单
22
、浚单
26
、浚单
28
种子纯度,
引物
umc1666
检测浚单
29
种子纯度,这两个引物多
态性好、带型清晰、稳定性好。
利用确定的引物分别对浚单系列品种进行种
子纯度检测,测序胶每排样品均有相应的浚单系列
亲本及标准杂交种作为对照
(
图
3;
图
4)
。共检测
3
000
个样品,其中检测出母本带型的有
35
个样品,
占检测样品数的
1.17%
,检测出父本带型的有
13
个
样品,占检测样品总数的
0.43%
,没有检测到异株
样品。检测的车次中最高纯度为
100%
,最低为
96%
,
平均为
98.4%
。
2
讨论
玉米杂交种制种一般采用人工去雄、人工自然
授粉的方法以保证种子纯度,但生产中常出现杂交

