Basic HTML Version


分子植物育种
(
网络版
), 2012
年
,
第
10
卷
,
第
1559-1564
页
Fenzi Zhiwu Yuzhong (Online), 2012, Vol.10, 1559-1564
http://mpb.5th.sophiapublisher.com
1561
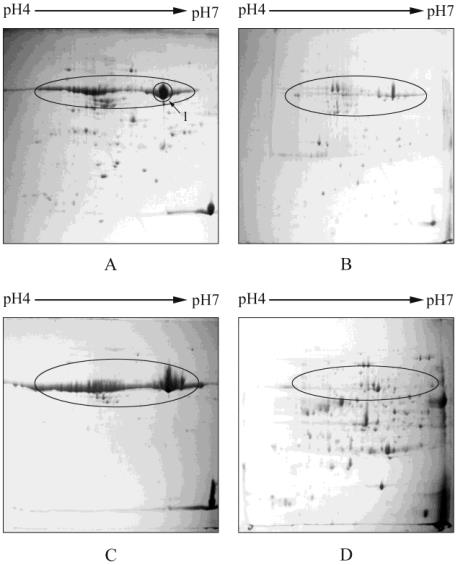
图
2 Tris-HCl/TCA
-丙酮法及
PEG
沉降法提取的萝卜叶片蛋
白
2
-
DE
图谱
注
: A: Tris-HCl/TCA
-丙酮法
; B: PEG
沉降法提取组分
1; C:
PEG
沉降法提取组分
2; D: PEG
沉降法提取组分
3
Figure 2 2
-
DE profiles of proteins extracted from radish leaves
using Tris-HCl/TCA-Acetone Method and PEG Fractionation
Note: A: Tris-HCl/TCA-Acetone Method; B,C,D: PEG Fractio-
nation F
1
, F
2
, F
3
, respectively
到大幅的提高。
在
Tris-HCl/TCA
-丙酮法和
PEG
沉降法
F
3
组分
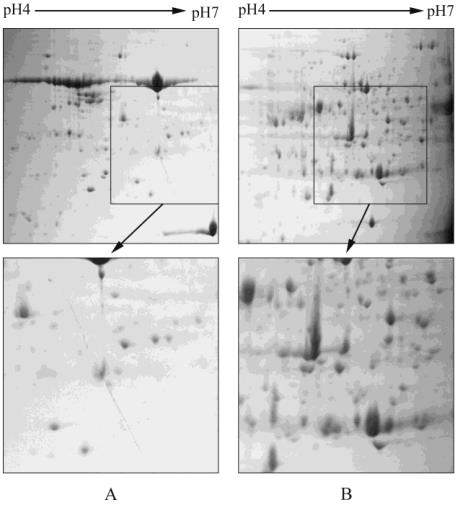
的蛋白凝胶电泳图谱上选取对应区域放大
(
图
3)
,观
察到
F
3
组分蛋白点较为清晰而且密集
(
图
3B)
,图
3A
中检测不到的低丰度蛋白点在图
3B
上可以清晰地
被检测到,表明在经过
PEG
分级沉降之后,低丰度
蛋白的可检测率显著提高。
综合分析可以看出,改良的
PEG
分级沉降法制
备萝卜叶片蛋白,可以有效地将
RuBisCO
沉降在
F
2
组分
(
图
2C)
中,
F
3
组分
(
图
2D)
中的低丰度蛋白分离
效果显著提高,可以鉴定出更多的低丰度蛋白。因
此,在进行萝卜叶片蛋白质组分析研究时,与
TrisHCl/TCA
-丙酮法相比,
Tris-HCl
粗提后的
PEG
分级沉降法更适合分离萝卜叶片低丰度表达蛋白,
可显著提高低丰度蛋白的检测率。
2
讨论
蛋白质组学的关键环节之一是蛋白质样品的
图
3 Tris-HCl/TCA
-丙酮法蛋白
(A)
与
PEG
沉降法组分
F
3
(B)
的
2
-
DE
图谱局部比较
Figure 3 Comparison of 2
-
DE profile of proteins extracted by
Tris-HCl/TCAAcetone method (A) and PEG Fractionation F
3
(B)
制备,蛋白样品的质量也会直接影响双向电泳中凝
胶图谱的重复性及分辨率。植物叶片中存在多种不
参与基因调控的高丰度蛋白,如
RuBisCO
,但由于
胶条能够承载的蛋白样品量有限,会造成部分低丰
度蛋白不能被胶条吸胀
(Xi et al., 2006)
,此外,由于
RuBisCO
可能与植物叶片中的低丰度蛋白相结合,
也会造成部分低丰度蛋白不能被检测到
(Corthals et
al., 2000)
。
Xi
等
(2006)
发现采用
PEG
分级沉降法,大多数
的
RuBisCO
被沉降在
16%
的
PEG
组分中。在此基础
上,本研究将其实验步骤进行简化并采用
SDSPAGE
以及双向电泳技术,比较改良的
PEG
分级沉降法与
Tris-HCl/TCA
-丙酮法对萝卜叶片蛋白质的分离效
果。分析
SDS-PAGE
凝胶图谱,萝卜叶片蛋白质大
小亚基
(LSU, SSU)
主要存在于
F
2
和
F
1
组分中,而
F
3
组分中蛋白质谱带明显增多,且分布均匀。
PEG
沉
降法通过分级沉降,可以有效地将萝卜叶片蛋白质
进行分级分离,提取的叶片蛋白质的
2
-
DE
凝胶图谱
的分析表明,高丰度的
RuBisCO
被大量地沉降在
F
2
组分中,少量富集于
F
1
组分中,而
F
3
组分中几乎不
含
RuBisCO
;
2
-
DE
图谱上检测到的蛋白点总数之和
显著多于
Tris-HCl/TCA
-丙酮法。综合研究结果表

