Basic HTML Version
王鹏凯等
, 2011,
鹅掌楸属植物高质量基因组
DNA
提取方法研究
,
分子植物育种
Vol.9 No.28 (doi: 10.5376/mpb.cn.2011.09.0028)
1205
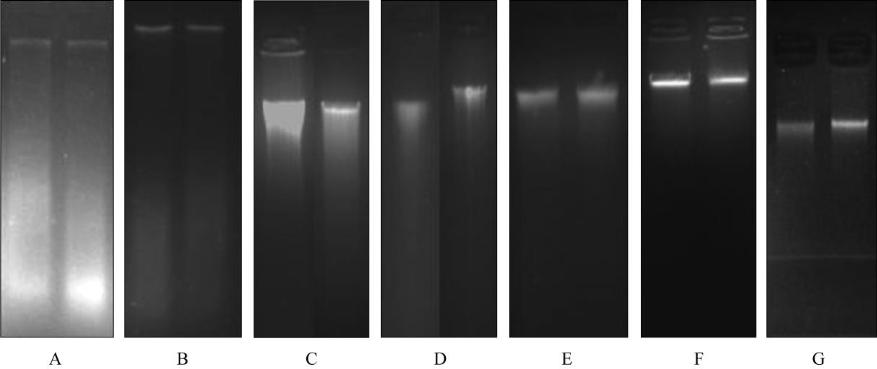
琼脂糖电泳检测显示
CTAB
法和
PEG
法可以较
好的保存
DNA
的完整性
(
图
1A, 1B)
,而使用
QIAGEN
试剂盒和
BioTeke
试剂盒提取的
DNA
条带
有明显拖尾和丝状痕迹,说明提取的
DNA
发生降解
和存在次生代谢物残留,无法保证其完整性和纯度
(
图
1C, 1D)
。
CTAB
法和
PEG
法虽然都有
RnaseA
消化
图
1
不同方法提取
DNA
电泳图
(
左侧泳道为幼芽
DNA,
右侧泳道为幼叶
DNA)
注
: A: CTAB
法
; B: PEG
法
; C: QIAGEN
试剂盒
; D: BioTeke
试剂盒
; E: PEG+CTAB
法
; F: PEG+QIAGEN
试剂盒
; G:
PEG+BioTeke
试剂盒
Figure 1 1% agarose gel electrophoresis of genome DNA extracted by different methods (Left lane: bud DNA, Right: leaf DNA)
Note: A: CTAB; B: PEG; C: DNeasy Plant Mini Kit (QIAGEN); D: New Plant DNA Extraction Kit (BioTeke); E: PEG washing
buffer with CTAB; F: PEG washing buffer with DNeasy Plant Mini Kit (QIAGEN); G: PEG washing buffer with New Plant DNA
Extraction Kit (BioTeke)
RNA
的步骤,但是无法完全消化
RNA
,使
DNA
样品
的纯度无法达到要求
(
图
1A, B)
。
QIAGEN
和
BioTeke
试剂盒在处理
RNA
污染方面具有良好的表现
(
图
1C,
1D)
。
PEG
漂洗液配合使用法得到的三个样品
DNA
完整性有较大提高的同时很好的解决了
RNA
污染的
问题,其中
CTAB
法提取的
DNA
条带稍有拖尾,说
明
DNA
发生轻微降解;
QIAGEN
试剂盒表现非常突
出,提取的
DNA
电泳条带整齐明亮,说明
DNA
完整
且得率较高;
BioTeke
试剂盒提取的
DNA
电泳条带较
QIAGEN
试剂盒稍暗,但条带比较整齐,说明该方
法得到的
DNA
完整性良好但得率稍低
(
图
1E, 1F, 1G)
。
1.3
北美鹅掌楸和杂交鹅掌楸基因组
DNA
提取结果
根据七种不同提取方法的比较,选择提取效果
最好的
PEG+QIAGEN
试剂盒法提取北美鹅掌楸和
杂交鹅掌楸基因组
DNA
,用
Nanodrop
计算纯度和得
率。结果如表
2
所示。
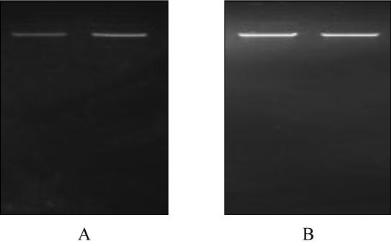
1%
琼脂糖凝胶电泳进行
DNA
完整性检测,电泳结果如图
2
所示。从检测结果可
以看出
PEG+QIAGEN
试剂盒法提取的北美鹅掌楸
和杂交鹅掌楸基因组
DNA
无论在得率和纯度方面
都符合要求,同时也很好的保存了
DNA
的完整性。
图
2
北美鹅掌楸与杂交鹅掌楸基因组
DNA
电泳图
(
左侧泳道
为幼芽
DNA,
右侧泳道为幼叶
DNA)
注
: A:
北美鹅掌楸
; B:
杂交鹅掌楸
Figure 2 Electrophoresis of genome DNA of
L. tulipifera
and
L.
Hybrids
(
L. chinense
×
L. tulipifera
) (Left: bud DNA Right:
leaf DNA)
Note: A:
L. tulipifera
B:
L. Hybrids
(
L. Chinense
×
L. tulipifera
)
with 1% agarose gel

