基本HTML版本

医学遗传学与疾病研究
(
网络版
), 2012
年
,
第
1
卷
,
第
2
篇
,
第
6
-
14
页
Yixue Yichuanxue Yu Jibing Yanjiu (Online), 2012, Vol.1, No.2, 6
-
14
http://mgdr.5th.sophiapublisher.com
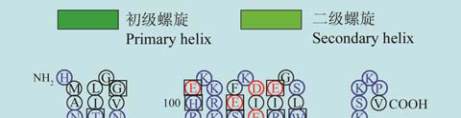
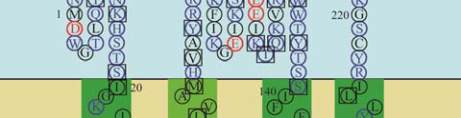
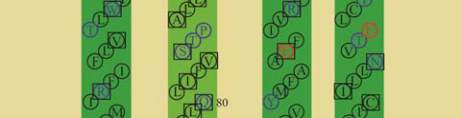
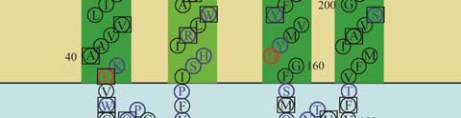
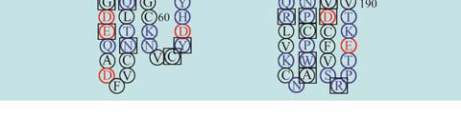
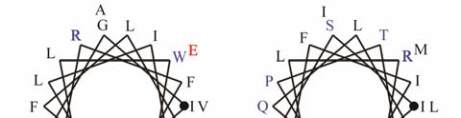
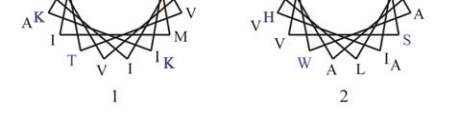
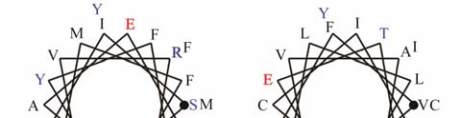
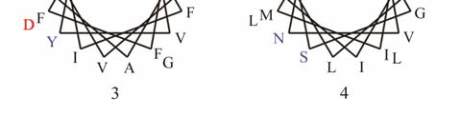
11
图
8
人类
GJB2
蛋白
SOSUI
分析结果
注
:
蛋白跨膜模拟图中
,
方框框出的为致病性突变位点
;
4
个跨膜螺旋轮中
,
黑色的为疏水性残基
,
蓝色的为亲水中
性残基
,
蓝色加粗的为亲水碱性残基
,
红色加粗的为亲水酸
性残基
Figure 8 The result of SOSUI analysis in human GJB2 protein
Note: In the transmembrane protein figure, boxes highlight
residues that are pathogenic mutation sites; In the transmembrane
helix figure, hydrophobic residues are black; Neutral hydrophilic
residues are blue; Hydrophilic basic residues are blue bold;
Hydrophilic acidic residues are red bold
变
GJB2
蛋白的表达缺失,
V95M
突变蛋白虽然在
细胞膜上形成了间隙连接蛋白孔道却无生化偶联
通透性的功能。
Choi
等
(2009)
人也通过实验证明跨
膜区
T86R
突变使蛋白无法形成间隙连接功能;
Ambrosi
等
(2010)
人对跨膜区
4
种错义突变进行研
究,发现其中
T135A
突变导致膜通道关闭,
M34A
突变导致膜通道的活性严重降低。此外,
Oshima
等
(2011)
人对
M34A
突变蛋白的电子晶体结构进行
了研究,发现
M34A
对
N
端通道口的形成产生影响,
使通道几乎呈关闭状态。由此推测,当错义突变发
生在跨膜区且突变改变了氨基酸的性质时,该突变将
会影响蛋白在细胞膜上的表达或膜通道的通透性。
2
讨论
间隙连接是细胞间直接进行物质交流的唯一
通道,无论在脊椎还是无脊椎动物都发挥着重要的
作用。在脊椎动物间隙连接的通道由
connexin (Cx)
蛋白家族构成,在小鼠体内约有
20
种间隙连接蛋
白基因,在人类已知有
21
种间隙连接蛋白基因。
所有的
Cx
都是具有
4
次横穿细胞膜的肽,形成了
细胞外环、内环和跨膜区的三部分结构。跨膜区和
细胞外区高度保守,然而不同
Cx
的功能差异是由
这些区域的氨基酸序列的不同造成的。间隙连接介
导的细胞间信号的异常可以引起全身多系统的疾
病,由于不同的
Cx
在各器官、组织的分布不同,
因此引起与之相关的疾病也不同。
Cx26
在全身大部
分组织器官均有表达,并以皮肤和内耳表达水平最
高。在内耳中,
Cx26
蛋白在人耳蜗的血管纹、基底
膜、螺旋器均呈现较高水平的表达,
GJB2
基因的
突变可致
Cx26
蛋白结构或功能发生障碍,从而导
致遗传性
NSHL
。然而不同耳聋人群具有不同
GJB2
基因的突变谱
(
种族特异性
)
,以及
GJB2
基因突变
所致临床表型多样性,一直是该基因突变致聋研究
的热点之一。
本文利用生物信息学方法对
GJB2
分子进化特
征与
NSHL
的遗传效应进行了关联性分析,结果表
明,人类
GJB2
氨基酸序列具有高度保守性,分析
推测约有
166
个固定的氨基酸位点。
GJB2
序列的
膜外区保守度高于跨膜区,跨膜区保守度高于胞质
区,其中
CT
结构域保守度极低。序列
109~125
区
域空间结构保守性低,两个非保守区位点发生致病
性错义突变的概率较低。序列第
113
位和第
123
位
推测为“空间结构保守位点”,预测发生在这两位
上的错义突变会影响蛋白质的功能。发生在跨膜区

